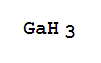
制法 在-20℃至-15℃温度下利用置换反应可得到非配位的GaH3,如:
Me3N·GaH3(s)+BF3(g)→GaH3(l)+Me3N·BF3(s)
GaH3像ⅢA族(B,Al,In)的氢化物一样,纯的单体至今尚未制得。已知加入乙醚作为溶剂可增强氢化镓单体的稳定性,生成GaH3·(C2H5)2O,低于35℃不分解,但室温下逐渐转化为多聚物(GaH3)n。
氯化镓GaCl3与氢化铝锂(LiAlH4)在乙醚中的反应是制备GaH3二聚体(GaH3)2的一种方便的方法。GaCl3像硼与铝的相应化合物一样,是共价不饱和的,可作为一种电子受体。因此可假设它像乙硼烷的结构一样,在(GaH3)2分子中有两个氢桥,即:
乙镓烷在-21.4℃熔化,是一种可流动的无色液体。它对热是比较稳定的,但在130℃时开始分解成为金属镓和氢气。于0℃时GaH3的多聚体(GaH3)n可由在乙醚中的氢化镓锂溶液与三氯化镓反应而制得。
3nLiGaH4+nGaCl3→4(GaH3)n+3nLiCl
如图所示
多聚体(GaH3)n的结构
(GaH3)n是一种白色固体,比低分子量的氢化镓稳定得多。与水反应很慢,但与稀酸猛烈反应,同时逸出氢气。在真空下加热至140℃开始释放出氢气,在380~400℃下多聚体完全分解为镓和氢气。在多聚体(GaH3)n(如图所示)中镓原子的配位数不是(如在乙镓烷中)4,而是(如在氢化铝中)6,但它们的结构是相似的。
GaH3是一种略显极性的黏胶油状体,不溶于非极性溶剂中,能与多种配位体(H-和具有配位原子N,P,As,O或S)形成配合物。它的熔点是-15℃,在室温下分解为镓和氢气。氢化镓(Ⅲ)具有相当强的还原能力,但至今尚未找到任何实际应用。