HNO3
 O;
O; C
C
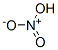
按稀硝酸和浓硝酸分述如下。
(一)稀硝酸
工业上制取稀硝酸的方法有常压法、综合法、中压法和GP双加压法。
常压法是氨一空气混合气在常压下氧化成氮氧化物,氮氧化物在常压下经多级填料吸收塔进行水吸收,以制得稀硝酸。其尾气经碱吸收后排放。
综合法足净化后的氨-空气混合气经鼓风机升压,预热后通过纸板过滤器进入氧化炉,氧化成一氧化氮。气体进人冷却洗涤器,进入氧化塔进行一氧化氮氧化,随即进入酸吸收塔,由塔顶加入水进行吸收生成稀硝酸。由塔底部流出的硝酸进入漂白塔,制得稀硝酸成品。
中压法是采用蒸汽透平与尾气膨胀压缩机直接驱动空气透平压缩机。经漂白塔、氧化塔、吸收塔制得稀硝酸成品。
GP双加压法是采用两台氧化炉并联操作。生成的气体再经冷凝吸收,制得稀硝酸产品。
稀硝酸生产其
4NH3+5O2→4NO+6H2O
2NO+O2→2NO2
3NO2+H2O→2HNO3+NO
(二)浓硝酸
工业上制取浓硝酸的方法有间接法、直接法(见发烟硝酸)和超共沸酸的蒸馏法。间接法是先制得稀硝酸,然后稀硝酸在脱水剂存在的情况下,经提纯、精馏、冷凝、漂白等工序制得浓硝酸,作为脱水剂的有硝酸镁和浓硫酸等。超共沸酸蒸馏法包括氨的氧化、超共沸酸的制取和直接蒸馏等步骤。
精制方法:硝酸中所含杂质大多为氮的氧化物。精制时添加少量硝酸钾进行蒸馏即可除去。
以工业硝酸为原料,经精馏、冷凝分离除去杂质后,再经微孔膜过滤去除杂质,得到无色透明的电子级硝酸。
(三)制法 将发烟硝酸用电导水稀释到90%左右。加热蒸馏,首先蒸出的是浓硝酸,弃去前段馏分(约总量10%),沸点逐升至120.5℃,达到恒沸点,此时蒸出的硝酸含量68.5%,为保证试剂质量,要留有一定量残液。根据所需硝酸的浓度要求,可加适量水稀释。初馏物和残液可作为原料反复使用。用压缩空气将溶在硝酸溶液中的少量NO2吹出,可得无色透明溶液。要除去氯离子,可在蒸馏前加入硝酸银,直到不再有氯化银沉淀生成为止,并在30~40℃下静置澄清,采用虹吸将清液移至蒸馏器中,可根据氯离子含量,来确定硝酸银用量(一般过量20%左右)。
(四)硝酸制备一般采用氨氧化法:以铂为催化剂,将氨氧化为一氧化氮,再用空气与浓硝酸全部氧化为二氧化氮,然后用浓硝酸吸收,生成发烟硝酸,再经过解吸而得。或由氨氧化生成一氧化氮,再与空气中的氧作用生成二氧化氮,用水吸收得到稀硝酸。
1.用途极广的重要化工原料,主要用于制造硝酸铵、硝酸铵钙、硝酸磷肥、氮磷钾等复合肥料。有机工业用于制造四硝基甲烷、硝基己烷、l-硝基丙烷、2,4-二硝基苯氧乙醇等硝基化合物。染料工业用于对硝基苯甲醚、4,4’-二硝基二苯醚、对硝基苯酚、2,5-二氯硝基苯等染料中间体的合成。涂料工业用于制造硝基清漆和硝基瓷漆。医药工业用于制造硝基苯乙酮。硝酸作为氧化剂可氧化醇、苯胺及其他化学品。并已经用于火箭的推进剂。硝酸也是制造钙、铜、银、钴和锶等的硝酸盐的原料。
2.硝酸属于强氧化性酸,对大多数金属有腐蚀作用。高浓度硝酸对金属有钝化作用。硝酸用于清洗碳素钢、不锈钢、铜、黄铜、碳素钢不锈钢组成的设备,可除去水垢、铁锈,对 α-Fe2O3和磁性Fe3O4有良好的溶解力。 在生物法污水处理过程中,可用作微生物养分中的氮源等。此外,硝酸广泛用于化肥、化纤、医药、染料、橡胶等的制造,在国防工业、冶金工业、印染工业以及其他工业部门中,也是不可缺少的重要的分析化学试剂。
3.硝酸是最重要的基本化工原料之一,是一种用途极广的化工产品。在水处理领域,硝酸可用作碳素钢、不锈钢设备的清洗除锈剂,用在污水、废水的氧化还原处理过程中;在污水的生物法处理过程中,可用作微生物养分中的氮源等。
4.用作蚀刻剂及强酸性清洗腐蚀剂,可与冰醋酸、双氧水等配合使用。
5.用作分析试剂,如作溶剂,氧化剂。还用于有机合成,制取各类硝基化合物。
6.用途极广,主要用于化肥、染料、国防、炸药、冶金、医药等工业。[17]
1.化学性质:硝酸为强酸,遇光及空气部分发生分解。加热时分解生成一氧化氮和氧气。稀硝酸比较稳定,70%~90%硝酸在0℃,阴暗处不发生分解。浓硝酸氧化性强,标准氧化电位。
2.硫、磷经硝酸氧化可生成硫酸和磷酸。能溶解多种金属形成硝酸盐溶液。铁、铬、铝等金属在浓硝酸中处于钝态而不作用,但可溶于稀硝酸中。锡、锑、钼等生成不溶性氧化物,金、铂等不发生反应。硝酸能与多种有机化合物发生硝化或氧化反应,生成硝基化合物或氧化产物。
3.稳定性[12] 稳定
4.禁配物[13] 还原剂、碱类、醇类、碱金属、铜、胺类、金属粉末、电石、硫化氢、松节油、可燃物如糖、纤维素、木屑、棉花、稻草或废纱头等
5.聚合危害[14] 不聚合
6.分解产物[15] 氮氧化物
1.性状:纯品为无色透明发烟液体,有酸味。[1]
2.熔点(℃):-42(无水)[2]
3.沸点(℃):83(无水)[3]
4.相对密度(水=1):1.50(无水)[4]
5.相对蒸气密度(空气=1):2~3[5]
6.饱和蒸气压(kPa):6.4(20℃)[6]
7.临界压力(MPa):6.89[7]
8.辛醇/水分配系数:0.21[8]
9.溶解性:与水混溶,溶于乙醚。[9]
10.黏度(mPa·s,20ºC):0.89
11.比热容(KJ/(kg·K),98.15%):1.99
12.比热容(KJ/(kg·K),90.33%):2.22
13.比热容(KJ/(kg·K),70.00%):2.56
14.比热容(KJ/(kg·K),40.00%):2.80
15.电导率(S/m,30.42%):7008
16.电导率(S/m,51.78%):5554.2
17.电导率(S/m,78.96%):1945.1
18.电导率(S/m,98.50%):167.8
19.生成热(KJ/mol,H.N.30):173.79
20.生成热(KJ/mol,H.NO.20):264.12
21.生成热(KJ/mol,NO2.O.H):182.21
1.急性毒性[10] LC50:130mg/m3(大鼠吸入,4h);67ppm(小鼠吸入,4h)
2.刺激性 暂无资料
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[11] 该物质对环境有危害,应特别注意对水体和土壤的污染。
| 国标编号: | |
| CAS: | 7697-37-2 |
| 中文名称: | 硝酸 |
| 英文名称: | Nitric acid |
| 别 名: | 氢氮水;硝强水;Aqua fortis;Hydrogen nitrate;Azotic acid |
| 分子式: | HNO3 |
| 分子量: | 63.0 |
| 熔 点: | -41.59℃,沸 点:83℃ |
| 密 度: | 1.41(20℃)(68%硝酸) |
| 蒸汽压: | |
| 溶解性: | |
| 稳定性: | 遇潮气或受热分解而成有刺鼻臭味的二氧化氮 |
| 外观与性状: | 透明、无色或带黄色有独特的窒息性气味的腐蚀性液体 |
| 危险标记: | |
| 用 途: | 是一种用途极广的重要化工原料之一 |
1、摩尔折射率:9.60
2、摩尔体积(cm3/mol):38.8
3、等张比容(90.2K):107.4
4、表面张力(dyne/cm):58.6
5、极化率(10-24cm3):3.80